Úrsula Segoviano
Salud
La UE autoriza 'Leqembi', el primer tratamiento que retrasa el alzhéimer: ¿cuándo llegará a España?
Úrsula Segoviano
Miércoles 16 de abril de 2025
ACTUALIZADO : Miércoles 16 de abril de 2025 a las 18:18 H
6 minutos
Está indicado para pacientes que tienen solo una o ninguna copia de ApoE4
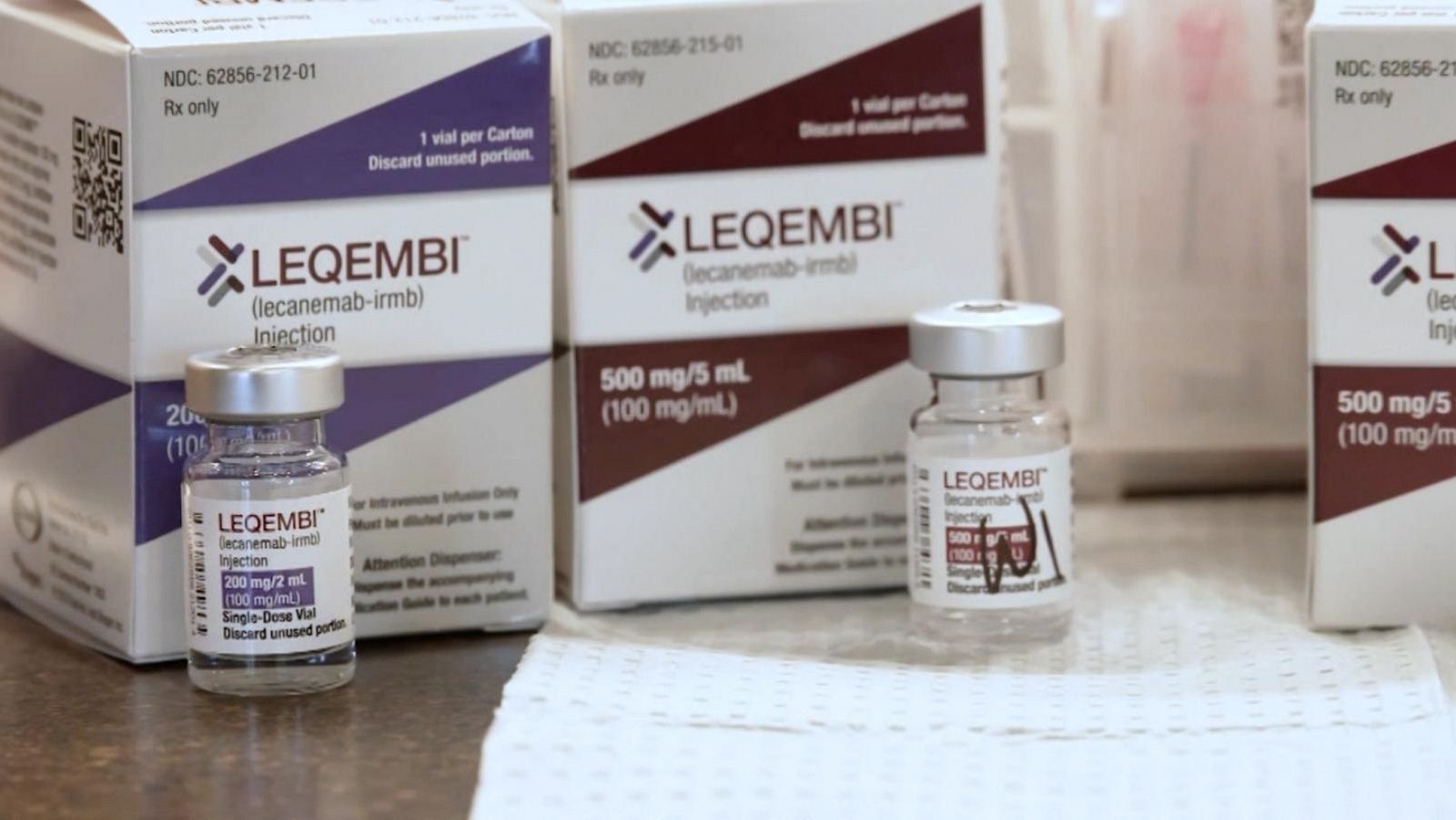
La Comisión Europea (CE) ha dado el visto bueno definitivo para el uso en la Unión Europea de lecanemab, comercializado por Eisai y Biogen como 'Leqembi', el primer tratamiento que ralentiza el deterioro cognitivo leve característico del alzhéimer durante las primeras fases de la enfermedad.
La autorización se ha concedido después de que el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) recomendara el pasado noviembre su comercialización tras meses de revisiones y reticencias.
Los pacientes que podrán beneficiarse de este fármaco son aquellos que tienen solo una copia del gen ApoE4, una variante genética que aumenta el riesgo de desarrollar la enfermedad, o ninguna, y que presentan placas de beta amiloide en el cerebro, según ha informado la CE en un comunicado.
"La autorización se basa en la evaluación científica positiva de la Agencia Europea de Medicamentos, que concluyó que los beneficios de este medicamento superan los riesgos en una población específica de pacientes con dicha enfermedad, siempre que se apliquen medidas de minimización de riesgos. Por lo tanto, la decisión de autorización de hoy también establece condiciones estrictas para el uso de 'Leqembi', así como requisitos claros de mitigación de riesgos", señala la Comisión.
El organismo europeo ha establecido unas condiciones que deben implementar los 27 Estados Miembros para los que se ha autorizado el fármaco, junto a Islandia, Liechtenstein y Noruega. En concreto, los países deben garantizar que todos los profesionales sanitarios que se espera que prescriban 'Leqembi', así como los pacientes que vayan a utilizarlo, tengan acceso a la información sobre el mismo.
Además, el inicio de la administración del medicamento en todos los pacientes debe realizarse mediante un sistema de registro centralizado obligatorio, implementado como parte de un programa de acceso controlado (PAC) para contribuir a su uso seguro y eficaz, y evitar su empleo fuera de indicación.
Primer avance en 20 años
"Lecanemab es el primer tratamiento que ha demostrado que la reducción de las placas de beta amiloide en el cerebro se asocia con la ralentización del deterioro cognitivo en pacientes en la etapa inicial de la enfermedad. Este es un avance histórico en un campo donde la innovación ha sido escasa o nula en los últimos 20 años", ha destacado el presidente y director ejecutivo de Biogen, Christopher A. Viehbacher, tras conocer la aprobación de la CE.
El principio activo de 'Leqembi', lecanemab, es un anticuerpo monoclonal (un tipo de proteína) que se adhiere y elimina las protofibrillas tóxicas, además de dirigirse y reducir las placas de beta amiloide que se forman en el cerebro de las personas con alzhéimer. Las protofibrillas son una forma tóxica clave de beta amiloide que se acumula en el cerebro y causa daño neuronal.
Después de la concesión de la Comisión Europea, será cada Estado Miembro el que tenga que tomar sus decisiones sobre el precio y el reembolso, teniendo en cuenta el papel y el uso potenciales de este medicamento en el contexto de su sistema sanitario nacional. Al hilo, el director ejecutivo de Eisai, Haruo Naito, ha afirmado que su compañía está colaborando con las autoridades de cada país para facilitar este proceso y dar acceso a los pacientes elegibles "lo antes posible".
Esta es la decimotercera aprobación de lecanemab en todo el mundo. La Administración de Alimentos y Medicamentos de EEUU (FDA, por sus siglas en inglés) concedió su autorización en julio de 2023, tras el respaldo unánime de su eficacia clínica por parte de un comité asesor. En EEUU se acordó proporcionar una amplia cobertura para lecanemab, para pacientes elegibles con alzhéimer en fases tempranas. También ha sido aprobado para fase temprana por las autoridades reguladoras de Japón en 2023, y en 2024 por las de China, Corea del Sur, Hong Kong e Israel.
CEAFA lo celebra
La Confederación Española de Alzheimer (CEAFA) ha celebrado la autorización de la Comisión Europea (CE) para la comercialización de lecanemab. Para CEAFA, lecanemab ha demostrado efectos positivos sobre la progresión de la enfermedad, así como sobre los criterios de valoración secundarios, como la calidad de vida y la carga del cuidador. Además, desde la Confederación se refieren a este hito como "un avance innegable e importante para un campo que llevaba más de dos décadas esperando nuevos medicamentos".
"La autorización se basa en la evaluación científica positiva de la Agencia Europea de Medicamentos, que concluyó que los beneficios de este medicamento superan los riesgos en una población específica de pacientes con dicha enfermedad, siempre que se apliquen medidas de minimización de riesgos. Por lo tanto, la decisión de autorización también establece condiciones estrictas para el uso de Leqembi, así como requisitos claros de mitigación de riesgos", concreta en su comunicado emitido este martes la CE.
¿Cuándo estará disponible en España?
Después del anuncio de autorización por parte de la Comisión Europea a escala de la Unión Europea, las compañías farmacéuticas comercializadoras deben solicitar su registro en España –algo que, de inicio, como han hecho en otros países, se espera que no tarden en hace–, así como la financiación del fármaco en la Comisión Interministerial de Precios de Medicamentos y Productos Sanitarios (CIPM), que se reúne todos los meses.
Dicho esto, se desconoce cuál será el plazo exacto en el que los pacientes con alzhéimer se podrán empezar a beneficiar de 'Leqembi' en España, pero si se atiende al último informe de 'Indicadores de acceso a terapias innovadoras en Europa 2023', de la Federación Europea de la Industria Farmacéutica (Efpia), señala que los nuevos fármacos tardan una media de 661 días en llegar a los pacientes españoles.
En resumen, según la información existente, se puede estimar que 'Leqembi' podría estar disponible en el mercado farmacéutico español en un plazo inferior a los dos años.


